1.2 Formarea moleculelor. Legături chimice
Molecula este o particulă materială neutră din punct de vedere electric, care se poate divide prin metode chimice şi care păstrează proprietăţile substanţelor din care face parte. Moleculele sunt formate din atomi.
Substanţele a căror molecule sunt formate din atomi identici se numesc substanţe simple. (O2, F2, Cl2, Br2, I2, S8, P4, metalele ş.a.) iar substanţele a căror molecule sunt formate din atomi diferiţi se numesc substanţe compuse (H2O, SO2, H2SO4, CH4, CH3COOH ş.a.).
Prescurtat, o moleculă este descrisă prin formula chimică. Formula chimică descrie o moleculă din punct de vedere calitativ (cuprinzând simbolurile chimice ale speciilor atomice care o alcătuiesc) şi cantitativ (prin indici care arată numărul de atomi de acelaşi fel din moleculă).
Orice moleculă se caracterizează prin masa moleculară şi prin mărimi structurale (lungimi de legături, unghiuri de legătură). Masa moleculară se exprimă în u.a.m. şi se calculează prin însumarea masei tuturor atomilor componenţi.
Cantitatea dintr-o substanţă exprimată în grame, numeric egală cu masa moleculară se numeşte mol (moleculă gram, masă molară) şi se notează cu m. Numărul de moli, n, se calculează împărţind masa de substanţă (exprimată în grame) la masa molară, m:
![]() (1.2)
(1.2)
Cu excepţia gazelor rare, atomii celorlalte elemente au tendinţa de a reacţiona, formând molecule sau alte specii chimice.
Între atomii care prezintă o diferenţă mare de electronegativitate (adică între atomii de metale şi atomii de nemetale) se stabileşte legătura ionică.
Legătura ionică se realizează prin cedare de electroni (de către atomii de metal) şi acceptare de electroni (de către atomii de nemetal) fenomene în urma cărora atomii se transformă în ioni cu sarcini contrare, care se atrag între ei prin forţe de natură electrostatică.
Printre substanţele ionice se pot aminti clorura de sodiu (NaCl), oxidul de calciu (CaO), sulfura de potasiu (K2S) ş.a.
Forţele electrostatice sunt forţe relativ tari deci distrugerea legăturii ionice necesită un aport relativ ridicat de energie. Ca urmare substanţele ionice sunt solide cristaline cu temperaturi medii şi mari de topire şi de fierbere.
În stare solidă ionii au poziţii fixe în reţeaua cristalină de aceea solidele ionice nu conduc curentul electric. În topitură şi în soluţie aceste substanţe sunt conductori de ordinul II (conductori ionici). Tot din cauza structurii rigide a cristalelor ionice, substanţele sunt casante.
Legătura covalentă se realizează între atomi cu electronegativităţi mari şi cu diferenţa între electronegativităţi mică sau egală cu zero, prin punerea în comun a electronilor impari (neîmperecheaţi) ai atomilor care reacţionează. Dacă fiecare atom pune în comun câte un electron se stabileşte o legătură simplă:
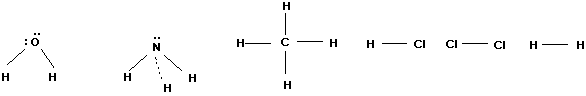
Apă Amoniac Metan Acid clorhidric Clor Hidrogen
Dacă atomii îşi pun în comun, fiecare, câte doi electroni între ei se realizează legături duble cum sunt cele din molecula de oxigen, de etenă, etc.
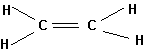
O = O
Oxigen Etenă
Între atomii care îşi pun în comun, fiecare câte trei electroni se stabilesc legături triple ca cele din molecula de azot, de acetilenă ş.a.
![]()
N
![]() N
N
Azot Acetilenă
Numărul de electroni puşi în comun de către fiecare atom descrie multiplicitatea legăturii covalente. Deci, legătura covalentă poate fi – din punct de vedere al multiplicităţii – simplă, dublă sau triplă.
În unele cazuri numai unul dintre atomi îşi pune în comun cu alt atom o pereche de electroni. Între aceşti atomi se realizează o legătură covalent coordinativă. Atomul care pune în comun perechea de electroni se numeşte donor iar celălalt atom este acceptor. Asemenea tip de legătură se întâlneşte în ionul de amoniu, NH4+ (N este atom donor, H+ este acceptor) şi în combinaţiile complexe.
Moleculele covalente în care perechea de electroni de legătură este uniform atrasă de atomii participanţi sunt molecule apolare (nepolare). Asemenea molecule sunt cele formate din atomi de acelaşi fel (H2, O2, N2, halogenii) sau din atomi diferiţi dar care formează molecule simetrice (CO2, CH4, CCl4).
Dacă perechea de electroni de legătură este deplasată mai mult spre unul dintre atomi (cel cu electronegativitatea mai mare) moleculele sunt polare adică sunt dipoli. Printre acestea se pot aminti monoxidul de carbon (CO), acidul clorhidric (HCl), hidrogenul sulfurat (H2S), amoniacul (NH3), apa (H2O), acidul fluorhidric, HF ş.a.
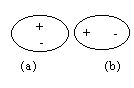
Fig. 1.1 Notarea simbolică a moleculelor apolare (a) şi a dipolilor (b)
Între moleculele care conţin atomi de hidrogen legaţi de atomi cu electronegativitate mare şi volum atomic mic se pot stabili legături de hidrogen. Asemenea legături se pot stabili între moleculele de apă, de acid fluorhidric, de alcooli, de acizi carboxilici sau chiar în aceeaşi moleculă în acizi alcooli, acizi fenoli ş.a.
Între ioni şi moleculele polare, între moleculele polare, între moleculele polare şi cele apolare se manifestă forţe de atracţie electrostatică care însă sunt slabe deoarece sarcinile acestor particule sunt mici (fracţionare). Între oricare două particule (atomi, ioni, molecule polare sau apolare) se manifestă interacţiuni de tip van der Waals. Existenţa acestor forţe explică o serie de proprietăţi ale substanţelor precum şi starea de agregare, posibilitatea de lichefiere a gazelor formate din molecule apolare, solubilitatea, punctele de fierbere şi punctele de topire.
Dacă interacţionează atomi cu electronegativităţi mici (atomi de metale) şi dacă diferenţa de electronegativitate este zero (atomii aceluiaşi metal) sau mică, între atomi se stabileşte legătura metalică.
Prin interacţiunile dintre atomi rezultă substanţele anorganice şi substanţele organice.
Substanţele anorganice se pot clasifica în patru categorii: oxizi, hidroxizi (baze), acizi şi săruri.
Oxizii sunt compuşii oxigenului cu metalele sau cu nemetalele. Formula generală a unui oxid este E2nOn unde n este valenţa elementului generator de oxid. Denumirea oxizilor se poate face în diverse moduri:
a) dacă elementul generator de oxid are o singură formă de valenţă oxizii se denumesc:
oxid de “numele elementului” Na2O – oxid de sodiu, CaO – oxid de calciu
b) dacă elementul prezintă valenţă variabilă, după numele său se precizează şi valenţa sa, FeO – oxid de fier (II) sau Fe2O3 – oxid de fier (III).
Hidroxizii sunt compuşi care conţin în moleculă un singur atom de metal şi un număr de grupări hidroxid, HO-, egal cu valenţa metalului. Formula generală a unui hidroxid este Mn(OH)n în care M este un metal cu valenţa n. Denumirea hidroxizilor este diferită în funcţie de compoziţia lor:
a) hidroxid de “numele elementului” NaOH – hidroxid de sodiu, Ca(OH)2 – hidroxid de calciu, Al(OH)3 – hidroxid de aluminiu.
b) La numele metalului se adaugă valenţa sa, dacă metalul prezintă valenţă variabilă: Fe(OH)2 – hidroxid de fier (II), Fe(OH)3 – hidroxid de fier (III).
Notă: excepţie de la definiţia hidroxizilor face NH4OH – hidroxidul de amoniu, întrucât NH4+ nu este un ion metalic dar se comportă în reacţiile chimice similar cu ionii metalelor alcaline.
Acizii sunt substanţe care conţin în moleculă atomi de hidrogen şi un radical acid. Atomii de hidrogen se pot înlocui cu atomii de metale şi se obţin săruri. Orice acid anorganic se scrie începând cu atomul de hidrogen, HA.
Acizii în molecula cărora nu există atomi de oxigen se numesc hidracizi iar cei care conţin atomi de oxigen se numesc oxoacizi.
Denumirea acizilor şi a sărurilor este determinată de compoziţia lor, Tabelul 1.2.
Tabel 1.2 Denumirea generală a acizilor şi a sărurilor
|
Acid |
Sare |
|
|
|
Hidracid, HE |
Acid “E”-hidric HCl acid clorhidric H2S acid sulfhidric |
“E”-ură de “numele metalului NaCl – clorură de natriu FeCl2 – clorură de fier (II) FeCl3 – clorură de fier (III) PbS – sulfură de plumb |
|
|
Oxoacid |
Acid “E”-os dacă E are valenţă inferioară H2SO3 – acid sulfuros |
“E”- -it de “numele metalului” Na2SO3 – sulfit de natriu FeSO3 – sulfit de fier (II) Fe2(SO3)3 – sulfit de fier (III) |
|
|
|
|||
|
|
|||
|
|
|||
|
Acid “E”-ic dacă E are valenţă superioară sau numai o formă de valenţă H2SO3 – acid sulfuric H2CO3 – acid carbonic |
“E”- -at de “numele metalului” Na2SO4 – sulfat de natriu FeSO4 – sulfat de fier (II) Fe2(SO4)3 – sulfat de fier (III) |
|
|