1.3. Fenomene chimice. Legile chimiei
Toate transformările din natură se numesc fenomene. Fenomenele în care se schimbă natura substanţei se numesc fenomene chimice sau reacţii chimice. Fenomenele chimice se simbolizează prin ecuaţii chimice. Membrul stâng al ecuaţiei indică substanţele care reacţionează, reactanţii, iar membrul drept indică substanţele rezultate în reacţie, produşii de reacţie.
În desfăşurarea lor, fenomenele chimice respectă legile chimiei.
1. Legea conservării masei (M.V. Lomonosov, 1748 şi A.L. Lavoisier, 1772) exprimă relaţia dintre masele substanţelor care reacţionează şi care rezultă dintr-o reacţie şi se poate enunţa astfel: “Suma maselor substanţelor care reacţionează este egală cu suma maselor substanţelor care rezultă într-o reacţie” sau “numărul şi tipul atomilor care reacţionează este egal cu numărul şi tipul atomilor care rezultă într-o reacţie chimică” (numărul şi tipul atomilor se conservă pe parcursul unei reacţii):
2NaOH + H2SO4 = Na2SO4 + 2H2O
mNaOH + mH2SO4 = mNa2SO4 + mH2O
2x40 + 98 = 142 + 2x18
Legea se aplică în calcule chimice şi la stabilirea coeficienţilor ecuaţiilor chimice.
2. Legea proporţiilor definite (legea constanţei compoziţiei, legea lui J.L. Proust, 1805) se poate enunţa în forma: “Toate substanţele au o compoziţie calitativă şi cantitativă bine determinată. Legea se utilizează la scrierea corectă a formulelor chimice şi în calcule chimice.
3. Legea proporţiilor multiple (Legea lui J. Dalton, 1808) se aplică în cazurile în care din aceleaşi elemente, în condiţii diferite, rezultă mai multe tipuri de substanţe compuse: “Dacă reacţionează două elemente şi în condiţii diferite de reacţie se formează mai multe feluri de substanţe compuse, între cantităţile diferite dintr-un element care reacţionează cu aceeaşi cantitate din celălalt element există un raport de numere întregi şi mici”. Legea se utilizează la scrierea corectă a formulelor chimice şi în calcule chimice.
4. Legea echivalenţilor chimici (Legea lui Richter, 1871).
Echivalentul chimic este un număr care arată raportul de combinare sau raportul de substituire a unui element sau a unei substanţe cu un gram de hidrogen sau cu opt grame de oxigen. Cantitatea dintr-o substanţă, numeric egală cu echivalentul chimic şi exprimată în grame se numeşte echivalent gram.
a)
Echivalentul unui oxid metalic:
![]()
![]()
![]()
b)
Echivalentul unui hidroxid: ![]()
![]()
![]()
c)
Echivalentul unui acid: 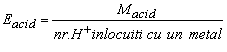
NaHSO4
![]()
H2SO4
Na2SO4
![]()
d)
Echivalentul unei sări: ![]()
![]()
![]()
e) Echivalentul unei substanţe sau al unui element care participă la reacţii redox:
![]()
|
2Fe + 3Cl2 = 2FeCl3 |
16HCl + 2KMn VII+O4 = 5Cl2 + 2MnII+Cl2 + 2KCl + 8H2O |
|
|
|
Enunţul legii echivalenţilor chimici este “Masele substanţelor care reacţionează sunt direct proporţionale cu echivalenţii lor”:
![]() (1.3)
(1.3)
2NaOH + H2SO4
= Na2SO4 + 2H2O adică
![]() sau
sau ![]()
5. Legea volumelor constante (Gay-Lussac, 1808) are acelaşi sens ca şi legea lui Proust dar se aplică numai la cazurile în care reacţionează şi rezultă substanţe în stare gazoasă: “Între volumele substanţelor care reacţionează precum şi între volumele substanţelor care reacţionează şi care rezultă există un raport constant de numere întregi şi mici”
6. Legea lui Avogadro (1811), iniţial elaborată sub forma unei ipoteze pentru a explica Legea Gay-Lussac, se enunţă astfel: “Volume egale de gaze diferite, măsurate în aceleaşi condiţii de presiune şi de temperatură, conţin acelaşi număr de molecule”. Consecinţele acestei legi prezintă importanţă practică deosebită:
- s-a putut demonstra astfel că substanţele simple, în stare gazoasă au moleculă diatomică (O2, Cl2, N2, H2,…)
- orice mol de substanţă gazoasă, în condiţii normale de presiune şi de temperatură (273K şi 1 atm), ocupă un volum de 22,4L (volumul molar).
- Numărul de molecule dintr-un mol de orice substanţă este egal cu 6,023.1023 molecule (numărul lui Avogadro).