4.4.2 Purificarea apei
Purificarea apei se realizează prin diferite procedee în funcţie de destinaţia ei finală.
Din apa potabilă, impurităţile mecanice se îndepărtează prin sedimentare, etapă în care se adaugă şi substanţe chimice cu proprietăţi coagulante ca de exemplu Al2(SO4)3 care prin hidroliză se transformă în Al(OH)3, sub formă de gel ce înglobează o parte din impurităţi:
Al2(SO4)3 + 6H2O ![]() 2 Al(OH)3
2 Al(OH)3
![]() + 3H2SO4
+ 3H2SO4
După sedimentare apa se filtrează prin straturi de nisip din ce în ce mai fin şi în final se sterilizează cu diferiţi agenţi oxidanţi: ozon, hipoclorit de natriu, clor, radiaţii ultraviolete.
Necesarul de apă în laboratoare se obţine prin distilarea apei potabile. Apă de înaltă puritate se poate obţine prin distilare dublă (apă bidistilată), triplă etc.
Apa industrială, utilizată ca agent termic sau ca materie primă în sinteze, se purifică prin dedurizare şi demineralizare.
Dedurizarea este operaţia de îndepărtare a ionilor de Ca2+, Mg2+ şi Fe2+ din apa dură. Operaţia se realizează prin precipitarea acestor ioni sau prin reţinerea lor pe schimbători de ioni.
Duritatea temporară se poate îndepărta prin:
a) fierberea apei dure:
Ca(HCO3)2.nH2O
![]() CaCO3
CaCO3 ![]() + CO2
+ CO2![]() + (n+1) H2O
+ (n+1) H2O
b) tratarea apei dure cu lapte de var:
Ca(HCO3)2.nH2O
+ Ca(OH)2 = 2CaCO3
![]() + (n+2) H2O
+ (n+2) H2O
c) tratarea apei dure cu hidroxid de natriu (sodă caustică):
Ca(HCO3)2.nH2O
+ 2NaOH = CaCO3 ![]() + Na2CO3 + (n+2) H2O
+ Na2CO3 + (n+2) H2O
Duritatea totală se poate înlătura prin:
a) tratarea apei dure cu carbonat de natriu (sodă de rufe):
CaCl2.nH2O
+ Na2CO3 = CaCO3![]() + (nH2O + 2NaCl)
+ (nH2O + 2NaCl)
b) tratarea apei dure cu fosfat trisodic sau cu polimetafosfat de sodiu:
3CaCl2.nH2O
+ 2Na3PO4 = Ca3(PO4)3![]() + (3nH2O + 6NaCl)
+ (3nH2O + 6NaCl)
mCaCl2.nH2O
+ 2(NaPO3)m = mCa(PO3)2![]() + (mnH2O + 2mNaCl)
+ (mnH2O + 2mNaCl)
c) trecerea apei dure peste schimbători de ioni.
Schimbătorii de ioni sunt substanţe macromoleculare naturale (zeoliţi), artificiale (permutiţi) sau sintetice (răşini) care au proprietatea de a schimba ionii lor cu ionii din soluţiile cu care intră în contact şi în care nu se dizolvă.
Zeoliţii se notează Z-Na, unde Z este un rest macromolecular; ei sunt silicaţi hidrataţi care conţin ioni de aluminiu şi ioni ai metalelor alcaline.
Permutiţii, se notează P-Na unde P este un rest macromolecular; ei sunt silicaţi dubli de aluminiu şi sodiu, obţinuţi prin topirea cuarţului cu caolin, cu carbonat de sodiu sau cu sulfură de sodiu şi cărbune.
Răşinile sintetice, conţin un rest organic, R, care este un produs reticulat de copolimerizare, de tip stiren-divinilbenzen. Pe acesta se află grefate grupe active acide (carboxil, -COOH, sulfonice, -SO3H sau fenolice -OH) sau bazice (amine, -NH2, sau amine N-substituite).
Răşinile acide şi sărurile lor cu metale alcaline (uzual cu sodiu) au proprietatea de a schimba cationii pe care îi conţin, inclusiv H+ cu cationi din soluţiile cu care vin în contact. Aceste răşini sunt cation-active şi se numesc cationiţi. În reacţiile de schimb ele se simbolizează R-H respectiv R-Na.
Răşinile cu caracter bazic sunt anion-active, se numesc anioniţi şi au proprietatea de a reţine anionii din soluţiile cu care vin în contact. În reacţiile de schimb ionic se simbolizează R-OH sau R-Cl funcţie de anionul ce poate fi schimbat (hidroxid, respectiv clorură).
În România, răşinile schimbătoare de ioni se fabrică la VIROLITE Oraşul Victoria. Alte sortimente de răşini schimbătoare de ioni, fabricate în lume sunt de tip Amberlite, Wolfatite, Dowex, Sephadex, Duolite etc.
Pentru dedurizarea apei, schimbătorii de ioni sunt încărcaţi în coloane de dimensiuni corespunzătoare cu debitul de apă care se tratează. Schimbul ionic se realizează de obicei în două coloane – una de cationit, cealaltă de anionit – care funcţionează în paralel cu alte două coloane în care se face regenerarea schimbătorilor uzaţi.
Dacă se consideră că duritatea este imprimată de prezenţa CaCl2, schimbul ionic care duce la dedurizarea apei poate fi reprezentat prin ecuaţiile:
Z-Na +
(CaCl2.nH2O)
![]() Z2Ca + (nH2O + 2NaCl)
Z2Ca + (nH2O + 2NaCl)
P-Na +
(CaCl2.nH2O)
![]() P2Ca + (nH2O + 2NaCl)
P2Ca + (nH2O + 2NaCl)
apă dedurizată
Reacţiile care au loc la trecerea peste un cationit sintetic conduc la obţinerea de apă dedurizată, cu caracter acid:
R-COOH(s) + (CaCl2.nH2O)(l)
![]() (R-COO)2Ca(s) + (nH2O +
2HCl)(l)
(R-COO)2Ca(s) + (nH2O +
2HCl)(l)
2R-COOH(s) + (Na2SO4.nH2O)(l)
![]() 2RCOONa(s) + (nH2O + H2SO4)(l)
2RCOONa(s) + (nH2O + H2SO4)(l)
Prin trecerea apei rezultate peste un anionit se obţine apă în care nu se mai găsesc nici un fel de ioni străini, numită apă demineraliazată:
R-NH2(s) + (nH2O
+ HCl)(l) ![]() R-NH3]+Cl-(s) +
nH2O(l)
R-NH3]+Cl-(s) +
nH2O(l)
Dacă se utilizează răşini schimbătoare de ioni, apa dură este trecută întâi peste un cationit apoi peste un anionit, Fig. 4.4.
Pentru regenerarea schimbătorilor de ioni se folosesc soluţii concentrate de clorură de sodiu (saramură), soluţii concentrate de acizi (de obicei HCl 4n) respectiv soluţii concentrate de hidroxide de sodiu sau soluţii de concentraţii medii de carbonat de sodiu:
P2Ca + 2NaCl
![]() 2 P-Na + CaCl2
2 P-Na + CaCl2
(R-COO)2Ca + 2HCl
![]() 2R-COOH + CaCl2
2R-COOH + CaCl2
2[R-NH3]]+Cl-
+ Na2CO3 ![]() 2R-NH2 + 2NaCl + CO2 + H2O
2R-NH2 + 2NaCl + CO2 + H2O
[R-NH3]]+Cl-
+ NaOH ![]() R-NH2 + NaCl + H2O
R-NH2 + NaCl + H2O
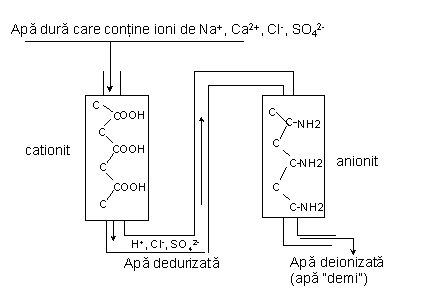
Fig. 4.4 Schema procesului de demineralizare a apei cu schimbători de ioni