Metalele sunt substanţe simple (elementare), solide la temperatura obişnuită, cu excepţia mercurului care este lichid la această temperatură, cristalizate īn reţele compacte.
Ele se deosebesc de celelalte substanţe simple printr-o serie de proprietăţi ca: luciu metalic, proprietatea de a absorbi lumina, sunt insolubile īn dizolvanţi comuni dar se dizolvă īn metale formānd aliaje. Prezintă conductibilitate termică şi electrică şi proprietăţi mecanice specifice (plasticitate, maleabilitate, ductilitate, tenacitate etc.)
Atomii metalelor au un număr mic de electroni (1...4) pe ultimul strat, cu excepţia bismutului care are 5 electroni pe ultimul nivel electronic.
Proprietăţile metalelor sunt determinate de un tip special de legătură care se stabileşte īntre atomii dintr-o reţea metalică, numită legătură metalică.
Tratarea cuantică a legăturii metalice, prin aplicarea teoriei orbitalilor moleculari a fost realizată de Sommerfeld (1927), Fermi şi Bloch (1929), Brillouin şi Pauling (1938) şi alţii. Conform acestei teorii, electronii dintr-o reţea metalică nu sunt perfect liberi ci sunt supuşi unui cāmp periodic existent īn reţea; īntr-o bucată compactă de metal, considerată o moleculă uriaşă, distribuţia electronilor este diferită de cea din atomii individuali liberi cum ar fi cei īn stare de gaz. Diferenţele sunt mai mici pentru nivelele mai apropiate de nucleu dar sunt semnificative pentru cele mai īndepărtate. Īn atomii individuali, electronii sunt distribuiţi īntr-un număr limitat de nivele de energie pe cānd īn metalul compact fiecare nivel energetic se multiplică īntr-un număr de nivele egal cu numărul atomilor din reţea, lărgindu-se astfel zonele īn care electronii au acces, respectiv īn reţeaua cristalină electronii se vor găsi īn zone (benzi) de energie permisă separate de zone (benzi) interzise. Nivelele interioare pot fi părăsite de electroni doar dacă metalul este iradiat cu raze X, pe această proprietate bazāndu-se şi un tip de analiză spectrală. Banda corespunzătoare nivelului ultim este cea care este extinsă īn īntreg cristalul metalic. Īn general ultima bandă de energie ocupată cu electroni se numeşte bandă de valenţă iar banda permisă, liberă, imediat superioară benzii de valenţă, se numeşte bandă de conducţie.
Prin aplicarea unei diferenţe de potenţial, electronii vor trece pe nivelele superioare ale aceleiaşi benzi, cazul metalelor alcaline, sau din banda de valenţă īn cea de conducţie, asigurānd conducţia electrică a metalelor.
Conductibilitatea unui metal se defineşte ca inversul rezistivităţii lui, r, fiind constantă pentru un metal dat, la temperatură constantă. Ţinānd seama de relaţia de calcul a rezistenţei, R, a unui conductor, conductibilitatea, k, se defineşte ca fiind inversul rezistenţei, opuse la trecerea curentului electric, de către un conductor cu lungime, l, şi arie , A, unitare, ec. (2.1). Metalele alcaline sunt unii dintre cei mai buni conductori electrici. Īn reţeaua metalelor alcalino-pămāntoase (metale ns2), banda de valenţă ns2N este complet ocupată, iar conductibilitatea acestor metale se explică prin suprapunerea benzii de valenţă ns2Ncu banda de conducţie np0 complet liberă. Conductibilitatea ridicată a metalelor tranziţionale se explică prin suprapunerea benzii ns2N complet ocupată cu banda (n-1)d, incomplet ocupată.
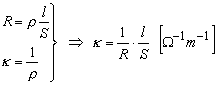 ; k
= f(metal, temperatură) (2.1)
; k
= f(metal, temperatură) (2.1)
Tratarea cuantică a stării solide explică comportarea de conductor, de izolator sau de semiconductor a reţelelor, comportare determinată de valoarea DE a diferenţei dintre energia benzii de valenţă şi cea a benzii de conducţie. Această energie defineşte o zonă numită bandă interzisă. Dacă valoarea este nulă, materialul este conductor, dacă este pānă īn 3eV, comportamentul este al unui semiconductor iar dacă banda interzisă depăşeşte 3eV materialul este izolator.