3.2.1.2. Proprietăţile generale ale sticlelor
Sticlele sunt materiale dure, casante, transparente. Nu au punct de topire ci interval de înmuiere putându-se prelucra prin turnare, sau prin suflare. Sunt rezistente la şoc termic şi la acţiunea agenţilor chimici cu excepţia HF, H3PO4, H3BO3 sau a alcaliilor topite. Rezistenţa la agenţii chimici creşte dacă pe suprafaţa sticlei se aplică o peliculă de ulei siliconic şi se tratează termic la 300-400oC ori prin tratare cu silicaţi sau aluminaţi.
Viscozitatea sticlei este diferită în funcţie de temperatură şi de compoziţie.
|
Fig. 3.1 Variaţia volumului molar cu temperatura, la obţinerea sticlei |
Tabel 3.3 Viscozitatea sticlei |
|
|
T |
h [P] |
|
|
Tg |
1013…1014 |
|
|
Tcălire |
1013,4 |
|
|
Tînmuiere |
107,6 |
|
|
Tprelucrare |
104 |
|
|
|
|
|
Devitrifierea, este proprietatea nedorită, a sticlei de a trece din stare amorfă (sticloasă) în stare cristalină. Fenomenul se datorează dezamestecării, compoziţiei necorespunzătoare sau a răcirii bruşte a sticlei puternic încăIzite. În Fig. 3.1 este prezentată variaţia volumului molar al sticlei cu temperatura. Pe diagramă se poate identifica temperatura de vitrifiere, Tg. Importante pentru prelucrarea sticlei sunt viscozităţile corespunzătoare temperaturilor de călire, de înmuiere şi de prelucrare, viscozităţi ale căror valori medii sunt prezentate în Tabelul 3.3.
Densitatea sticlei este cuprinsă în intervalul 2,2 g/cm3 (sticla de silice) şi 8 g/cm3 (sticla cristal).
Duritatea pe scara mineralogică a lui Mohs (Talc 1, Ghips 2, Calcit 3, Fluorina 4, Apatit 5, Feldspat 6, Cuarţ 7, Topaz 8, Corindon 9, Diamant l0) se situează în domeniul 5-6 pentru sticlele comune şi 6-7 pentru sticlele de laborator.
Coeficientul de dilatare termică, a, este mic şi creşte cu conţinutul de oxizi alcalini. Este direct corelat cu rezistenţa la şoc termic.
Conductibilitatea electrică este scăzută, fapt pentru care sticla este unul dintre cei mai buni izolatori electrici.
Rezistenţa mecanică a sticlelor este foarte scăzută, ele sunt casante.
Proprietăţile chimice ale sticlelor obişnuite sunt corelate cu compoziţia lor; majoritatea sorturilor de sticle cedează apei, în timp, ioni HO- imprimându-i un caracter alcalin. Sticla este atacată de acid fluorhidric ceea ce permite gravarea ei în scopuri tehnice sau estetice:
SiO2 + 4HF = SiF4 + 2H2O SiF4 + 2HF = H2SiF6
Topiturile de carbonaţi alcalini distrug sticla, formând silicaţi şi dioxid de carbon.
Aşa numita sticlă solubilă este silicatul de sodiu care se poate obţine în reacţia sticlei cu hidroxid şi sulfit de sodiu. Produşii rezultaţi, trataţi la cald, permit obţinerea acestui sortiment, utilizat pentru fabricarea de chituri, de cruste etc. Dacă aceiaşi produşi sunt trataţi cu acid clorhidric şi apoi se elimină apa din acidul polisilicic rezultat, se formează silicagelul utilizat ca agent de deshidratare care poate absorbi o cantitatea de apă de 333 de ori mai mare decât propria masă:
SiO2 +
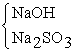 ®
Na4SiO4, Na2SiO3 + Na2Si2O5
®
Na4SiO4, Na2SiO3 + Na2Si2O5
![]() sticlă solubilă
sticlă solubilă
![]() Ż
+ HCl
Ż
+ HCl
acid polisilicic
![]() silicagel
silicagel