5.2.2. Soluţii particulare de electroliţi
Gama substanţelor care pot forma electroliţi este destul de largă. Dintre acestea însă acizii şi bazele prezintă o importanţă specială.
Soluţii de acizi şi soluţii de baze
Noţiunile de acizi şi baze au suferit în decursul timpului modificări datorate necesităţii de-a explica riguros apartenenţa unui electrolit la o anumită clasă funcţie de o proprietate caracteristică a clasei respective. Prima teorie generală şi unitară acido - bazică a fost elaborată independent de J.N. Brřnsted şi T.M. Lowry, în 1923. Într-un sistem acido-bazic, reacţiile se bazează pe schimbul speciei chimice, H+, adică a protonului. Aceste reacţii se numesc reacţii protolitice.
Conform teoriei Bronsted - Lowry un acid HA este o substanţă capabilă să cedeze protoni, formând baza conjugată, A- :
HA
![]()
![]()
![]() H+ +
A-
H+ +
A-
a1 b1
Baza conjugată, b1 , a unui acid tare, a1 , este o bază slabă şi reciproc.
O bază, B, este o substanţă capabilă să accepte protoni formând acidul conjugat, BH+; acidul conjugat, a2, al unei baze tari, b2, este un acid slab şi reciproc:
B + H+
![]() BH+
BH+
b2 a2
Protonul nu poate exista liber în soluţii, deci reacţiile protolitice pot avea loc numai în sisteme conţinând acizi şi baze:
HA1 +
B2 ![]() A1 +
HB2
A1 +
HB2
a1 b2 b1 a2
Substanţele care pot avea, funcţie de partenerul de reacţie, atât caracter de acid cât şi caracter de bază, prezintă caracter amfiprotic şi se numesc amfoliţi sau substanţe amfotere. Majoritatea solvenţilor sunt protici incluzând apa, alcooli, acizi carboxilici, amoniac.
Solvenţii care nu participă la reacţii protolitice sunt de obicei inerţi din punct de vedere chimic: benzen, clorbenzen, cloroform, tetraclorură de carbon şi se numesc solvenţi aprotici şi au conductivivtăţi foarte scăzute. Excepţie fac câţiva solvenţi aprotici ca dimetilsulfoxidul (DMSO), dimetilforamida (DMFA), acetonitrilul, care sunt utilizaţi, datorită conductivităţii lor mai ridicate, în sursele chimice de curent, în reacţiile organice care au mecanisme ionice etc.
Solvenţii amfiprotici sunt caracterizaţi de autoionizare. Pentru apă reacţia este:
2H2O
![]() HO- +
H3O+
HO- +
H3O+
ion ion
hidroxid hidroniu
Produsul ionic care caracterizează reacţia de autoionizare este:
PW = [H3O+][HO-] la 298 K: Pw298 = 10-14 (5.22)
Conform stoechiometriei reacţiei de autoprotoliză concentraţiile ionilor de hidrogen şi a anionilor hidroxid sunt egale:
cHO- =cH+ = (10-14)1/2 = 10-7 (5.23)
Concentraţia molară de protoni este un factor determinant în evaluarea caracterului acido - bazic al soluţiilor protice şi valorile acesteia sunt de obicei mici, de aceea Sřrensen a introdus în 1909 noţiunea de pH, potenţialul ionilor de hidrogen definit în soluţii diluate ca:
pH = -lg
![]() (5.24)
(5.24)
Analog, în solvent apă, se poate defini o noţiune similară, pOH:
pOH = -lg
![]() (5.25)
(5.25)
În apă pură: pH = pOH = 7 (5.26)
La introducerea unui acid în apă are loc procesul de protoliză, ca urmare a disociaţiei electrolitice:
HA + H2O ![]() A- +
H3O+
A- +
H3O+
Constanta de aciditate se calculează ca şi constantă de disociere, considerând concentraţia apei practic neschimbată:
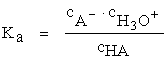 (5.27)
(5.27)
Valorile constantelor de aciditate sunt o măsură a tăriei acidului şi se exprimă de obicei ca pKa; în Tabelul 5.5 sunt prezentate valorile pKa corespunzătoare unor acizi des întâlniţi în practică.
pKa = - lg Ka (5.28)
În cazul unui acid tare procesul de disociere are echilibrul puternic deplasat la dreapta, cu grade de disociere ale acidului apropiate de 1, ca urmare reacţia se poate scrie:
HA + H2O ® A- + H3O+ sau pentru acizi polibazici: HnA + nH2O ® A- + nH3O+
Tabel 5.5 Valorile pKa pentru câţiva acizi în apă
Acidul |
Baza conjugata |
pKa |
|
Acizi foarte slabi, Ka < 10-7 |
||
|
HCO3- |
CO32- |
10,33 |
|
HIO |
IO- |
11 |
|
C6H5OH |
C6H5O- |
9,92 |
|
HBrO |
BrO- |
8,70 |
|
H2PO4- |
HPO42- |
7,21 |
|
Acizi slabi, Ka < 10-2 |
||
|
H2CO3 |
HCO3- |
6,35 |
HCl |
HCl- |
3,02 |
|
C(CH3)3COOH |
C(CH3)3COO- |
5,03 |
|
CH3COOH |
CH3COO- |
4,8 |
|
C2H5COOH |
C2H5COO- |
4,8 |
|
C6H5COOH |
C6H5COO- |
4,2 |
|
Acid lactic |
CH3CH(OH)COO- |
3,86 |
|
HCOOH |
HCOO- |
3,75 |
|
CH2ClCOOH |
CH2ClCOO- |
2,87 |
|
Acizi tari, Ka
|
||
|
H2SO4 |
HSO4- |
-3 |
|
HCl |
HCl- |
-3 |
|
HClO3 |
ClO3- |
-3 |
|
Acizi foarte tari, Ka
|
||
|
HClO4 |
ClO4- |
-8 |
Concentraţia de protoni la sfârşitul reacţiei, c, este egală cu concentraţia normală iniţială a acidului tare, cn, deci pH-ul , la concentraţii nu foarte mari este:
pH = - lg c = - lg cn = - lg n.cm (5.29)
Pentru acizii slabi procesul de disociere are echilibrul deplasat la stânga iar gradele de disociere sunt mici; aplicând legea lui Ostwald expresia constantei de aciditate se poate scrie:
 (5.30)
(5.30)
unde cu c s-a notat concentraţia molară iniţială a acidului, la momentul dizolvării lui în apă.
Pe baza valorilor constantei de aciditate, tabelate, şi a concentraţiei c, cunoscute din premizele experimentale, se poate determina gradul de disociere şi se poate calcula pH-ul soluţiilor:
![]() (5.31)
(5.31)
![]() (5.32)
(5.32)
Pentru acizii polibazici, cu n protoni în moleculă, concentraţia c a protonilor este egală cu concentraţia normală a acidului dar diferită de concentraţia molară, cm:
cH = cn, acid = n.cm, acid sau c = cn = n.cm (5.33)
Cu cât un acid este mai tare sau soluţia lui este mai concentrată cu atât valoarea corespunzătoare pH-ului este mai mică dar, indiferent de tăria lor, soluţiile apoase ale acizilor au 0 < pH < 7.
În apă, echilibrul de disociere a unei baze se poate scrie:
B + H2O
![]() A + HO-
A + HO-
La concentraţii mici se poate aproxima concentraţia apei ca fiind constantă şi constanta de bazicitate se calculează pe baza relaţiei:
![]() (5.34)
(5.34)
Valorile constantei de bazicitate sunt o măsură a tăriei bazei şi se exprimă ca pKb:
pKb = -lg Kb (5.35)
Tabelul 5.6 prezintă valorile pKb corespunzătoare câtorva baze.
Tabel 5.6. Valorile pKb ale unor baze şi pKa ale acizilor conjugaţi
|
Baza |
pKB |
Acidul conjugat |
pKa |
|
difenilamina |
13,16 |
(C6H5)2NH2+ |
0,84 |
|
anilina |
9,39 |
C6H5NH3+ |
4,61 |
|
piridina |
8,80 |
C6H5NH+ |
5,20 |
|
etilendiamina (K1) |
7,16 |
NH2(CH2)2NH3+ |
6,84 |
|
etilendiamina (K2) |
4,04 |
+NH3(CH2)2NH3+ |
9,96 |
|
amoniacul |
4,76 |
NH4+ |
9,24 |
|
tribenzilamina |
4,63 |
(C6H5CH2)3NH+ |
9,37 |
|
trimetilamina |
4,13 |
(CH3)3NH3+ |
9,87 |
|
metilamina |
3,30 |
CH3NH3+ |
10,70 |
|
etilamina |
3,25 |
C2H5NH3+ |
10,75 |
|
trietilamina |
3,20 |
(C2H5 )3NH+ |
10,80 |
|
dimetilamina |
3,13 |
(CH3)2NH2+ |
10,87 |
Tabelul indică şi faptul, uşor demonstrabil prin calcul, că în soluţii apoase, la 298K, pentru o pereche acid - bază conjugate:
pKb + pKa = 14 (5.36)
Hidroxizii metalelor alcaline fac
parte din categoria bazelor tari, pentru care echilibrul de disociere poate fi
considerat total deplasat la dreapta, (![]() ):
):
BOH ® B+ + HO-
În aceste condiţii concentraţia finală a anionilor hidroxid este egală cu concentraţia normală a bazei în momentul formării soluţiei, c :
pOH = - lg aHO- = - lg cHO- = - lg c (5.37)
pH = 14 - pOH (5.38)
Există şi anioni cu caracter de baze tari: alcoxizi, fenoxizi etc.
Pentru bazele slabe echilibrul de disociere conduce la valori ale gradului de disociere mici iar expresia constantei de bazicitate calculată cu ajutorul relaţiei lui Ostwald este, pentru o concentraţie molară iniţială a bazei, c:
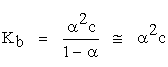 (5.39)
(5.39)
Cunoscând valoarea Kb, tabelată şi concentraţia bazei, c se poate determina gradul de disociere, pOH-ul şi în final, pH-ul:
![]() (5.40)
(5.40)
![]() (5.41)
(5.41)
![]() (5.42)
(5.42)
Cu cât o soluţia alcalină este mai concentrată sau baza este mai tare, valorile pH-ului sunt mai mari dar, indiferent de tăria lor, soluţiile apoase ale bazelor au 7< pH <14.
Reacţiile care implică formare sau disociere parţială de săruri sunt tot reacţii protolitice. La dizolvarea unei sări în apă are loc reacţia de reformare de acid şi bază din care a provenit sarea. Funcţie de tăria lor, acidul şi baza rezultate pot fi total sau parţial disociate în soluţie.
Reacţia unei sări cu apa prin care se obţine cel puţin un compus puţin ionizat se numeşte reacţie de hidroliză, (v. Cap.4). Soluţiile sărurilor ce provin din neutralizarea unui acid tare cu o bază slabă au caracter acid şi reciproc, soluţiile sărurilor ce provin din neutralizarea unei baze tari cu un acid slab au caracter bazic. Soluţia unei sări ce provine de la un acid slab şi o baza slabă are pH-ul situat în preajma lui 7, funcţie de raportul Ka/Kb (pentru valori supraunitare ale acestuia pH-ul este sub 7). Sărurile provenind din reacţia unui acid tare cu o bază tare nu hidrolizează iar soluţiile lor au pH-ul constant, 7.
Soluţiile formate din incompleta neutralizare a unui acid slab cu o bază tare sau a unei baze slabe cu un acid tare se numesc soluţii tampon; ele se pot simboliza schematic:
a) HAs / AsBt ex. CH3COOH / CH3COONa, pH de tamponare < 7
b) BsOH / AtBs ex. NH4OH / NH4Cl, pH de tamponare > 7
Soluţiile tamponate se obţin prin adăugarea de sisteme tampon la soluţiile obişnuite şi au proprietatea de a-şi menţine constant pH-ul la adăugare de cantităţi mici de acizi şi baze. Nu numai reacţiile chimice dar mai ales cele biochimice se desfăşoară la valori bine determinate ale pH-urilor, necesitând de aceea sisteme tampon. Astfel, multe medicamente sunt “tamponate” adică conţin un adaos de sistem tampon care permite menţinerea pH-ului stomacal.
Caracterul acid sau bazic al unei soluţii se evidenţiază fie instrumental (cu un pH-metru, un voltmetru sau un conductometru) fie colorimetric, cu ajutorul indicatorilor. Aceştia se utilizează ca soluţii sau impregnaţi pe suport celulozic în aşa numita hârtie indicator.
Tabel 5.7. Indicatori colorimetrici uzuali
|
Indicator |
pK |
Schimbarea culorii Mediu acid/mediu bazic |
|
metiloranj |
3,7 |
roşu – galben |
|
roşu de metil |
5,1 |
roşu – galben |
|
turnesol |
7,1 |
roşu – albastru |
|
fenolftaleina |
9,7 |
incolor – roşu |
|
galben de alizarină |
11,6 |
incolor - galben |
Indicatorii acido - bazici sunt acizi slabi sau baze slabe la care culoarea formei nedisociate diferă de culoarea formei ionice deci a căror culoare în mediu acid este diferită faţă de culoarea lor în mediul bazic. Ei se utilizează în cantităţi foarte mici pentru a nu altera caracterul acid sau bazic al soluţiei investigate de aceea ei trebui să aibă putere mare de colorare, Tabelul 5.7.
Valoarea pH-ul la care are loc modificarea culorii indicatorului se numeşte pH de viraj.