5.2.1. Disociaţia electrolitică
Svante Arrhenius a fost primul care a reuşit o tratare cantitativă a comportamentului electroliţilor slabi în soluţii: un electrolit slab Bn+An- disociază în soluţie după un proces de echilibru, formând n ioni dintre care υ+ cationi Bz+ şi υ- anioni, Az-:
Bn+An-
![]() υ + Bz+ +
υ - Az-
υ + Bz+ +
υ - Az-
Procesul este caracterizat la concentraţii mici de o constantă de disociere, K, a cărei valoare este o măsură a "tăriei electrolitului".
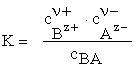 (5.18)
(5.18)
Gradul de conversie a moleculelor BA în ionii aferenţi se apreciază printr-o o mărime numită grad de disociere, α. Prin definiţie, α este raportul dintre numărul de molecule de tip BA care au disociat şi numărul total de molecule de tip BA dizolvate sau topite; α are valori cuprinse între 0 (neelectrolit) şi 1 (electrolit total disociat). Pentru electroliţi univalenţi (υ + = υ - = 1):
 (5.19)
(5.19)
relaţie cunoscută sub numele de legea diluţiei sau legea lui Ostwald.
Pentru soluţii de electroliţi slabi, în care α << 1, ecuaţia de mai sus se poate aproxima cu:
![]() (5.20)
(5.20)
La concentraţii mici gradul de disociere tinde către 1 adică electroliţii slabi se comportă asemănători cu cei tari.
Se pot considera electroliţi slabi majoritatea acizilor şi bazelor organice şi unele săruri ca: HgCl2, Hg(CN)2 sau Fe(SCN)3.
Pentru electroliţii tari gradul de disociere tinde către 1 (α ®1), iar conceptul de constantă de disociere îşi pierde sensul. Trebuie subliniat totuşi că se pot măsura experimental constante şi grade de disociere cu valori finite, consecinţă a caracterului neideal al soluţiilor şi al asociatelor formate. Sunt electroliţi tari majoritatea sărurilor precum şi acizii şi bazele tari care sunt prezentate şi în Tabelele 5.5 şi 5.6.
În urma disociaţiei electrolitice, numărul de particule din sistem se măreşte, fapt resimţit în valorile mărimilor care caracterizează proprietăţile coligative ale soluţiilor cum sunt ebulioscopia şi crioscopia. Astfel, pentru o soluţie ideal diluată a unui electrolit slab se pot corela factorul van't Hoff, i, cu gradul de disociere, α, şi numărul de particule, n, prin relaţia:
i = 1 + α (n
– 1) sau:
![]() (5.21)
(5.21)
Valoarea n rezultă direct din formula substanţei (ex. pentru AlCl3, n = 4, pentru Fe2(SO4)3, n = 5 etc.)