În Cap. 4 s-a arătat că apa are căldură specifică mare şi se găseşte în cantităţi mari în natură, deci se poate utiliza ca agent de răcire. Utilizarea apei în acest scop prezintă unele inconveniente, printre care se poate aminti:
- îngheaţă la 0oC, mărindu-şi volumul ceea ce poate provoca fisurarea şi chiar spargerea conductelor sau a recipientelor;
- are punctul de fierbere 100oC, respectiv intervalul de temperatură în care se află în stare lichidă este relativ mic, 0o – 100oC;
- prezentând duritate, din apă se vor depune cruste pe pereţii recipientelor;
- având proprietatea de a dizolva unele substanţe şi de a reacţiona cu metalele, poate provoca fenomenul de coroziune.
Pentru înlăturarea neajunsurilor amintite, în practică, se utilizează lichidele antigel. Acestea se obţin prin dizolvarea în apă, în proporţii bine determinate a alcoolilor (metanol, etanol, glicol, glicerină), a substanţelor care împiedică fenomenul de coroziune (borax - Na2B4O7) precum şi a substanţelor care împiedică fenomenul de spumare (dextrine). Temperaturile de fierbere şi de solidificare sunt determinate de concentraţiile în alcool. Lichidele de răcire a instalaţiilor industriale, utilizate în cantităţi foarte mari, sunt generic numite “solă” şi conţin săruri ieftine (CaCl2) sau amoniac dizolvate în apă demineralizată.
Lichidele antigel utilizate în practică pe scară largă, pentru sistemul de răcire al autovehiculelor, au de obicei ca principali componenţi apa şi etilenglicolul.
Exemplu 1. La ce temperatură va fierbe şi la ce temperatură se va solidifica soluţia apoasă 40% (%de masă) de metanol?
Malcool = 32 g / mol; Eapă = 0,52oC; Kapă = 1,86oC.
![]() şi
şi
![]()
![]() şi
şi
![]()
![]() şi
şi
![]()
Tfierbere = 100 + 10,83 = 110,83oC şi Tsolidificare = 0 – 38,75 = -38,75oC
Exemplu 2. În ce raport trebuie să se amestece apa cu glicerină (Mglicerină=92 g/mol, ρglicerină = = 1,27 g/cm3) pentru ca soluţia obţinută să nu îngheţe până la –19,45oC?
m = r.V şi rapă = 1 g/cm3
![]()
![]()
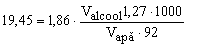 deci:
deci:
![]()