7.1. Conversia electrochimică a energiei
Un electrod este un conductor de ordinul I, electronic (metal, grafit) aflat īn contact cu un conductor de ordinul II, ionic (soluţie sau topitură de electroliţi). La interfaţa conductor electronic/conductor ionic au loc reacţii cu transfer de electroni care pot fi reacţii de oxidare sau reacţii de reducere. Dacă presupunem că un metal, M, este conductorul electronic şi o soluţie de sare a lui care conţine ioni Mz+ este conductorul ionic reacţiile care pot avea loc sunt:
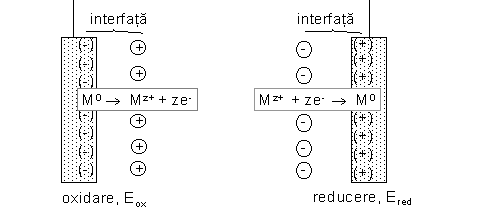
Fig. 7.1 Reacţii de electrod
Electronii nu pot exista liberi īn soluţii de aceea īn urma acestor reacţii, pe suprafaţa metalului apar sarcini electrice. Datorită atracţiei electrostatice īn apropierea suprafeţei se vor afla particule īncărcate electric (ioni), cu sarcini de semn contrar, realizānd o interfaţă cu sarcini electrice separate numită strat dublu electric.
Stratul dublu electric are, simplist vorbind, structura unui condensator şi este caracterizat de o diferenţă de potenţial numită potenţial de electrod. Dacă reacţia desfăşurată pe electrod este o oxidare, potenţialul se numeşte potenţial de oxidare, Eox, iar o reacţie de reducere este caracterizată de un potenţial de reducere, Ered.
Pilele electrochimice sau celulele galvanice sunt sisteme īn care reacţiile de la electrozi au loc spontan, cānd aceştia sunt reuniţi printr-un circuit exterior (consumator). Acestea sunt sisteme producătoare de energie electrică.
Sediul proceselor de oxidare (polul negativ) este anodul iar sediul proceselor de reducere (polul pozitiv) este catodul pilei.
Potenţialul unui electrod nu se poate determina īn valoare absolută ci doar relativ la un alt electrod cu care alcătuieşte o pilă. Convenţional, se determină potenţialul electrozilor relativ la electrodul standard de hidrogen, ESH, pentru care se consideră Eox = Ered = 0 V.
Un ESH este un electrod alcătuit dintr-o placă de platină pe care se barbotează hidrogen la 1atm, tot sistemul fiind imersat īntr-o soluţie de acid clorhidric cu concentraţia protonilor (H+) 1m, la temperatura de 25oC (298 K).
Metalele care funcţionează ca anod īntr-o pilă avānd catodul ESH sunt metale active. Metalele care sunt catod īntr-o pilă avānd anodul ESH sunt metale pasive sau metale nobile.
Orice electrod poate funcţiona īntr-o pilă fie ca anod fie ca şi catod, īn funcţie de electrodul partener; pentru un electrod dat Eox = -Ered.
Potenţialul de electrod depinde de natura materialului, M, de concentraţia (molară) a speciilor ionice, cMz+ şi de temperatură, T, conform cu relaţia Nernst a potenţialului de electrod. Pentru un electrod pe care are loc o reacţie de reducere forma acestei relaţii este dată de ec. (7.1):
Mz+ + ze- ® M0
![]() (7.1)
(7.1)
unde: F este numărul lui Faraday (96489 C).
Īn condiţii standard, la 298K şi 1atm, relaţia lui Nernst se poate scrie:
![]() (7.2)
(7.2)
Potenţialul unui electrod, măsurat la 298 K, pentru care concentraţia speciilor ionice este unitară, se numeşte potenţial standard de electrod, E0.
Uzual se caracterizează un electrod prin potenţialul său de reducere. Reactivitatea unui metal (sau a unei specii ionice) poate fi apreciată prin potenţialele standard de reducere, Ered0, prezentate īn Tabelul 2.3 (v. Cap. 2). Metalele active au potenţiale standard de reducere negative iar metalele pasive au potenţiale standard de reducere pozitive.
Īntr-o celulă galvanică specia care are potenţialul de reducere mai mic se oxidează la anod iar cea cu potenţialul de reducere mai mare se reduce la catod deci:
Eredanod < Eredcatod sau E(-) < E(+). (7.3)
Convenţional, o pilă se simbolizează descriindu-se lanţul electrochimic:
anod / electrolit / catod sau: anod / electrolit anodic // electrolit catodic / catod
Presupunem că o pilă funcţionează după următorul lanţ electrochimic, producānd o diferenţă de potenţial teoretică, E:
(-) M1 / M1z1+ // M2z2+ / M2 (+) cu: EM1 < EM2 şi E = E(+) - E(-) (7.4)
Potenţialului E, īntotdeauna pozitiv, se numeşte forţă electromotoare, f.e.m., şi se exprimă īn volţi.
Īn absenţa curentului electric (cānd pila nu furnizează curent) reacţiile care au loc la electrozi sunt reacţii de echilibru; cānd se īnchide circuitul printr-un consumator, reacţiile de electrod decurg practic īntr-un singur sens (oxidare anodică şi reducere catodică).
( - ) M1
![]() M1z1+ + z1e-
M1z1+ + z1e-
(+) M2z2+ + z2e-
![]() M2
M2
REMA: M1 + M2z2+
![]() M1z1+ + M2
M1z1+ + M2
Reacţia globală care descrie funcţionarea unei pile se numeşte reacţie electromotrice activă, REMA.
Cānd pila electrochimică funcţionează, potenţialele de lucru (Ei) corespunzătoare unui anumit curent cu intensitatea I, se vor modifica faţă de valorile de echilibru (Ee) datorită proceselor de polarizare. Procesele de polarizare au drept consecinţă apariţia de supratensiuni anodice, ha şi supratensiuni catodice, hc,. Tensiunea de lucru (U) la un anumit curent cu intensitatea I va fi:
U = Ei,2 - Ei,1
= (Ee,2 - hc)
- (Ee,1 - ha)
= E - ha
+ ![]() (7.5)
(7.5)
Trecerea curentului prin pilă va fi īnsoţită şi de o cădere ohmică datorate rezistenţei interioare a electrolitului, R, ce va diminua tensiunea de la borne:
U = E - (ha
+ ![]() ) -
RI
(7.6)
) -
RI
(7.6)
Pilele electrochimice constituie o sursă alternativă de energie, nepoluantă şi silenţioasă. Limitările utilizării lor sunt date īn primul rānd de raţiuni economice.
Pilele se clasifică īn trei categorii:
- pile primare īn care producerea de energie se realizează pe seama reactanţilor, existenţi īn pilă īn cantităţi limitate şi care nu se pot regenera prin electroliză.
- pile secundare sau acumulatori īn care reactanţii, aflaţi īn cantitate limitată īn pilă se pot regenera prin electroliză.
- pile de combustie alimentate continuu cu reactanţi īn timpul funcţionării.