|
6.4.2. Clasificarea şi proprietăţile generale ale lubrifianţilor |
6.1. Noţiuni Generale
Combustibilii sunt substanţe sau amestecuri de substanţe care printr-o reacţie de ardere sau printr-o reacţie nucleară degajă o mare cantitate de căldură.
Combustibilii se pot clasifica în funcţie de mai multe criterii:
- după natura reacţiei prin care se obţine căldură, combustibilii pot fi combustibili chimici sau combustibili nucleari.
- după starea de agregare, combustibilii sunt: solizi, lichizi, gazoşi.
- după provenienţă, combustibilii pot fi: naturali, artificiali, sintetici, Tabelul 6.1.
Tabelul 6.1. Tipuri de combustibili chimici
|
|
Naturali |
Artificiali şi sintetici |
Solizi |
- Lemn - Cărbuni de pământ: antracit, huilă, cărbune brun, lignit, turbă, şisturi bituminoase |
- Mangal- Cocs - Semicocs - Deşeuri combustibile: rumeguş, talaş |
|
Lichizi |
- Petrol (ţiţei) |
- Benzine - Petrol lampant - Motorine - Păcură - Gaze lichefiate “aragaz” - Alcooli inferiori |
|
Gazoşi |
- Gaze naturale, CH4 - Gaze de sondă |
- Gaz de apă - Gaz de generator - Gaz de cocserie - Acetilenă (Etină), C2H2 - Hidrogen, H2 |
Pentru ca o substanţă sau un amestec de substanţe să fie combustibil trebuie să îndeplinească o serie de calităţi printre care: să se găsească în natură în cantităţi mari, să fie uşor exploatabilă şi uşor de transportat, să ardă cu uşurinţă; să nu formeze, prin ardere, compuşi toxici şi /sau corozivi, să conţină puţine substanţe minerale, să aibă putere calorică mare.
Combustibilii uzuali sunt amestecuri de substanţe organice (care conţin atomi de C, H, S, O, N), substanţe minerale (care prin ardere se transformă în cenuşă) şi apă (care imprimă o anumită umiditate combustibilului). Combustibilii de calitate sunt cei cu un conţinut ridicat de carbon şi de hidrogen, prin a căror ardere se degajă o cantitate mare de căldură.
|
C + O2 = CO2 |
DH = - 393 kJ / mol = - 32,75 .103 kJ / kg C |
|
H2 + ˝ O2 = H2O(l) |
DH = - 286 kJ / mol = - 143 . 103 kJ / kg H2 |
|
H2 + ˝ O2 = H2O(v) |
DH = -242 kJ / mol = -121 . 103 kJ / kg H2 |
Prezenţa sulfului, chiar dacă prin ardere se degajă o cantitate mare de căldură, diminuează calitatea combustibilului întrucât dioxidul de sulf rezultat prin ardere este coroziv şi agent poluant:
S + O2 = SO2 DH = -292 kJ / mol = -9,125 . 103 kJ / kg S
Azotul, de obicei, prezent în cantităţi mici în combustibili – nu depăşeşte 2% - nu participă la ardere dar preia o parte din căldura degajată în proces, diminuând calitatea combustibilului.
Prezenţa oxigenului în combustibil determină micşorarea puterii calorice a acestuia deoarece o parte din elementele combustibile (C, H) sunt deja oxidate.
Substanţele minerale se transformă prin ardere în cenuşă care preia o parte din căldura degajată în reacţie. Cenuşa împiedică admisia aerului la combustibil, înfundă instalaţiile de ardere şi prin topire se transformă în zgură care se înglobează în combustibil.
Umiditatea defavorizează calitatea combustibililor deoarece o parte din căldura degajată la ardere se va utiliza pentru vaporizarea apei. Apa poate dizolva şi unii compuşi din gazele de ardere, favorizând acţiunea corozivă a acestora.
Puterea calorică, Q, a unui combustibil reprezintă cantitatea maximă de căldură care se poate degaja la arderea completă a unei unităţi de combustibil.
Puterea calorică se exprimă în unităţi de căldură raportate la unitatea de combustibil: pentru combustibilii solizi şi pentru cei lichizi unitatea de combustibil este kg iar pentru cei gazoşi unitatea de combustibil se consideră Nm3 (normal metru cub). Unităţile de măsură ale puterii calorice sunt: kJ/kg, kJ/Nm3, kcal / kg etc.
După cum apa rezultată din arderea hidrogenului sau cea sub formă de umiditate se consideră în gazele de ardere în stare de vapori sau în stare lichidă, puterea calorică a combustibilului se exprimă în putere calorică inferioară, Qi, şi respectiv putere calorică superioară, Qs.
Puterea calorică superioară, Qs, reprezintă cantitatea maximă de căldură care se degajă la arderea completă a unei unităţi de combustibil, dacă gazele de ardere au temperatura de 20oC. Apa fiind lichidă la această temperatură, puterea calorică superioară include şi căldura latentă de condensare a vaporilor de apă.
Puterea calorică inferioară, Qi reprezintă cantitatea maximă de căldură care se degajă la arderea completă a unei unităţi de combustibil, dacă gazele de ardere au temperatura mai mare de 20oC.
Pentru evaluarea resurselor de combustibil precum şi pentru compararea consumului de diverşi combustibili, se utilizează noţiunea de combustibil convenţional. Combustibilul convenţional este un combustibil fictiv, căruia i s-a atribuit puterea calorică inferioară de 7000 kcal/kg.
Raportul dintre puterea calorică inferioară a unui combustibil şi a combustibilului convenţional se numeşte echivalent caloric al combustibilului. De exemplu, dacă Qi a unui combustibil este 3500 kcal / kg, echivalentul caloric va fi 3500 / 7000 = 0,5, adică o tonă de combustibil este echivalentă cu 0,5 tone combustibil convenţional.
Calculul teoretic a cantităţii de căldură care se degajă la arderea unui combustibil hidrocarbonat CxHy se face pe baza reacţiei de ardere:
CxHy + (2x+y/2)/2 O2 ® xCO2 + y/2 H2O
Reacţia de ardere este însoţită de
degajare de căldură. Cantitatea de căldură cedată la arderea în condiţii
standard (1atm, 298K) a unui mol de substanţă cu formare de oxizi superiori se
numeşte căldură de ardere sau entalpie standard de ardere,
![]() . Entalpia standard de ardere este tabelată pentru unele
substanţe.
. Entalpia standard de ardere este tabelată pentru unele
substanţe.
Căldura reacţiei de ardere, ca de
altfel căldura oricărei reacţii, se poate calcula şi pe baza entalpiilor de
formare ale participanţilor la reacţie. Cantitatea de căldură, măsurată în
condiţii standard, cedată sau acceptată la formarea a un mol de substanţă, din
elementele componente, aflate în forma lor stabilă se numeşte entalpie
standard de formare, ![]() .
.
Pentru o reacţia generală în care cu litere mari s-au notat substanţele şi cu litere mici, coeficienţii stoechiometrici:
a1A1 + a2A2 +…. ® b1B1 + b2B2 +….
căldura de reacţie este :
![]() (6.1)
(6.1)
Pentru reacţia de ardere a unei hidrocarburi, ecuaţia (6.1) devine:
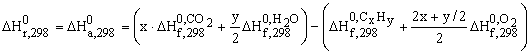 (6.2)
(6.2)
Entalpia de formare a substanţelor elementare este nulă.
Entalpiile standard de formare sunt tabelate pentru un număr foarte mare de substanţe. În Tabelul 6.2 sunt prezentate valorile corespunzătoare câtorva substanţe, majoritatea lor fiind combustibili.
Tabel 6.2 Entalpii standard de formare
|
Substanţă |
CH4 metan |
C2H2 etină |
C3H8 propan |
C4H10 butan |
C6H6 benzen |
C7H8 toluen |
CO2 |
H2O |
|
[kcal/ mol] |
-17,9 |
54,2 |
-24,8 |
-29,8 |
11,7 |
11,9 |
-94,1 |
-68,3 |
Entalpia reacţiilor exoterme (care decurg cu degajare de căldură) este negativă iar entalpia reacţiilor endotereme (care decurg cu absorbţie de căldură) este pozitivă.
Dacă se supun arderii n moli de combustibil, căldura degajată, Q se va calcula pe baza entalpiei standard de reacţie:
![]() (6.3)
(6.3)
Arderea combustibililor poate fi omogenă (combustibil gazoşi), eterogenă (combustibili solizi), mixtă (combustibili lichizi) şi se produce prin reacţii în lanţ.